Ejemplos de Enlace Covalente
Un enlace covalente es aquel en que dos átomos comparten electrones entre sí. Se tiene el propósito de completar los ocho electrones en la última capa, por lo que los átomos que participan en enlaces covalentes harán los necesarios con uno o varios átomos hasta lograrlo.
A principios del siglo XX los químicos empezaron a comprender cómo y por qué se forman las moléculas. El primer avance importante en este sentido surgió con la proposición de Gilbert Lewis de que la formación de un enlace químico implica que los átomos compartan electrones. Lewis describió la formación de un enlace químico en el Hidrógeno como:
H. + H. --> H : H
Este tipo de apareamiento de electrones es un ejemplo de enlace covalente, un enlace en el que dos electrones son compartidos por dos átomos. Los compuestos covalentes son aquellos que sólo contienen enlaces covalentes.
El par de electrones compartidos se presenta a menudo como una sola línea. Así, el enlace covalente de la molécula de hidrógeno se escribe como H-H. En el Enlace covalente, cada electrón del par compartido es atraído por los núcleos de ambos átomos. Esta atracción mantiene unidos a los dos átomos de la molécula de H2 y es la responsable de la formación de enlaces covalentes en otras moléculas.
En los enlaces covalentes entre átomos polielectrónicos sólo participan los electrones de valencia. Se considera por ejemplo, la molécula de Flúor F2. La configuración electrónica del elemento Flúor F es 1s22s22p5. Los electrones 1s son de baja energía y pasan la mayor parte del tiempo cerca del núcleo, por lo que no participan en la formación del enlace. En consecuencia, cada átomo de F tiene siete electrones de valencia, que se encuentran en 2s y 2p.
Si estos siete electrones se ubican por pares, nos quedará un electrón no apareado en F, de modo que la formación de la molécula de F2 se representa como sigue:
::: F . + . F ::: --> ::: F : F :::
O también: ::: F – F :::
Para formar F2 sólo participan dos electrones de valencia. Los demás, Electrones no enlazantes, se llaman Pares Libres, es decir, pares de electrones de valencia que no participan en la formación del enlace covalente. Así, cada átomo de F en la molécula de F2 tiene tres pares libres de electrones.
Pares libres --> (:::) F – F (:::)
Las estructuras con las que se representan los compuestos covalentes, como H2 y F2, se conocen como estructuras de Lewis. Una estructura de Lewis es una representación de un enlace covalente, donde el par de electrones compartidos se indica con líneas o como pares de puntos entre dos átomos, y los pares libres no compartidos se indican como pares de puntos en los átomos individuales. En una estructura de Lewis sólo se muestran los electrones de valencia.
Tomando como ejemplo la Estructura de Lewis para la molécula de Agua, se señalan a continuación los símbolos de puntos de Lewis para el Oxigeno con dos puntos no apareados, por lo que se espera que el Oxigeno pueda formar dos enlaces covalentes. Como el Hidrógeno tiene un solo electrón, sólo puede formar un enlace covalente.
Como el Hidrógeno tiene un solo electrón, sólo puede formar un enlace covalente, de modo que la estructura de Lewis para el agua es:
H : (:O:) : H
o H - (:O:) - H
En este caso, el átomo de Oxigeno tiene dos pares libres, en tanto el átomo de Hidrógeno carece de pares libres porque usó su único electrón para formar un enlace covalente.
Los átomos de Flúor y Oxigeno adquieren la configuración de gas noble (alcanzan 8 electrones en la última capa) en las moléculas de F2 y H2O al compartir electrones.
::: F : F ::: [8 electrones para el F]
H : (:O:) : H [8 electrones para el O]
La Regla del Octeto
La formación de estas moléculas ilustra la Regla del Octeto, propuesta por Lewis: un átomo diferente del hidrógeno tiende a formar enlaces hasta que se rodea de ocho electrones de valencia, es decir, se forma un enlace covalente cuando no hay suficientes electrones para que cada átomo individual complete su Octeto.
Al compartir electrones en un enlace covalente, cada átomo completa su octeto. Al compartir electrones en un enlace covalente, cada átomo completa su octeto. Para el hidrógeno, el requisito es que obtenga la configuración electrónica del Helio o un total de dos electrones.
La Regla del Octeto funciona principalmente para los elementos del segundo periodo de la Tabla Periódica. Estos elementos sólo tienen subniveles 2s y 2p, en los que puede haber un total de ocho electrones.
Tipos de Enlaces Covalentes
Los átomos pueden formar distintos tipos de enlaces covalentes. Existen Enlaces Sencillos y Enlaces Múltiples. Los enlaces múltiples se clasifican en Enlaces Dobles y Enlaces Triples.
- Enlace covalente sencillo: Dos átomos se unen por medio de un par de electrones.
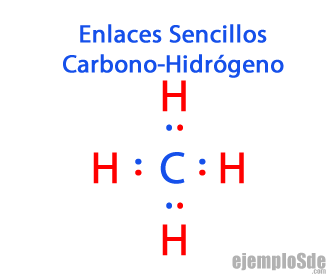
- Enlace covalente múltiple, es decir, cuando dos átomos comparten dos o más pares de electrones.
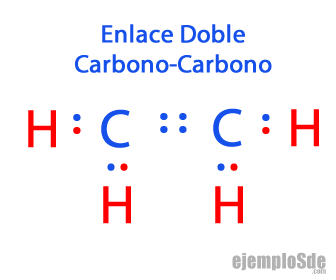
- Enlace doble: Cuando dos átomos comparten dos pares de electrones. Estos enlaces se encuentran en moléculas como Dióxido de Carbono CO2 y los Alquenos como el Etileno C2H4:
Dióxido de Carbono: O = C = O
Etileno: H2C = CH2
- El Enlace triple surge cuando dos átomos comparten tres pares de electrones, como en la molécula de Nitrógeno (N2):
- Enlace doble: Cuando dos átomos comparten dos pares de electrones. Estos enlaces se encuentran en moléculas como Dióxido de Carbono CO2 y los Alquenos como el Etileno C2H4:
: N ::: N : o : N ≡ N :
La molécula de Acetileno C2H2 también tiene un enlace triple, en este caso entre dos átomos de Carbono:
H : C ::: C : H o H-C ≡ C-H
En el Etileno y el Acetileno todos los electrones de valencia son enlazantes; no hay pares libres en los átomos de Carbono. De hecho, a excepción del Monóxido de Carbono, las moléculas estables de Carbono no tienen pares libres en estos átomos.
Los enlaces múltiples son más cortos que los enlaces covalentes sencillos.
La Longitud de Enlace se define como la distancia entre el núcleo de dos átomos unidos por un enlace covalente en una molécula.

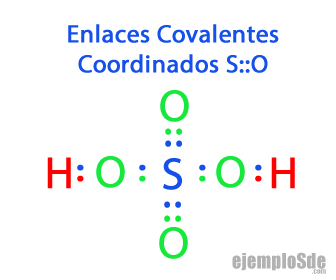
Enlace Covalente Coordinado
Otro tipo de Enlace Covalente muy importante es el Enlace Covalente Coordinado, en el que uno de los dos átomos que se enlazan es el que aporta los 2 electrones. Para diferenciarlo del Enlace Covalente sencillo, se indica con una flecha --> el enlace, partiendo del átomo que aporta hacia el átomo receptor.
Existen Enlaces Covalentes Coordinados en las moléculas que tienen varios átomos de Oxigeno. Se tiene por ejemplo la molécula de Ozono, en la que hay un enlace doble entre dos de ellos, y el tercero completa su octeto recibiendo un enlace coordinado, que se irá alternando entre los primeros en un fenómeno llamado Resonancia.
(O3): O = O --> O
(O3): O
- Seguir leyendo: Enlace iónico.
10 ejemplos de Enlace Covalente
- En el Acetileno C2H2 se presenta un enlace triple Carbono-Carbono: H : C ≡ C : H
- En el Etileno C2H4 se presenta un enlace doble Carbono-Carbono: H2C = CH2
- En el Propano C3H8 hay tres enlaces simples Carbono-Carbono: CH3-CH2-CH3
- En el Dióxido de Carbono CO2 hay dos enlaces dobles Carbono-Oxigeno: O = C = O
- En el Nitrógeno gaseoso N2 hay un enlace triple Nitrógeno-Nitrógeno: N ≡ N
- En el Sulfuro de Hidrógeno H2S hay dos enlaces simples Azufre-Hidrógeno: H – S – H
- En el Agua H2O hay dos enlaces simples Oxigeno-Hidrógeno H – O – H
- En el Propileno CH2 = CH- CH3 hay un enlace doble y uno simple, Carbono-Carbono. Los demás son simples, Carbono-Hidrógeno.
- En el Ozono O3 hay un enlace doble Oxigeno-Oxigeno, y un Enlace Covalente Coordinado Oxigeno-Oxigeno. O = O --> O
- En el Metano CH4 hay cuatro enlaces simples Carbono-Hidrógeno C-H.
