Ejemplos de Anhidridos De ácido
Los anhidridos de ácido son compuestos químicos formados por átomos de carbono (C), hidrógeno (H)y oxígeno (O). Son derivados de la unión de dos ácidos carboxílicos, que combinan sus cadenas desde un extremo y desprenden una molécula de agua. De ahí su nombre anhidridos, “sin agua”. Cuando las cadenas de R–COOH están combinadas, queda la fórmula general de los anhidridos de ácido, que es:
R–COO-OC–R’
Donde:
- R, R’: son cadenas hidrocarbonadas o radicales alkilo, que pueden ser idénticos o distintos.
- COO-OC: son las partes carboxílicas de cada ácido, de las que se les ha desprendido en total una molécula de agua.
Para comprender mejor la estructura de los anhidridos de ácido, es conveniente observar la ecuación química de su origen.
NOTA: el primer ácido se escribe R–COOH, como es frecuente; y el segundo se escribirá HOOC–R’, que es una escritura igualmente válida, a modo de espejo. Será una ayuda visual.
La ecuación es:
R–COOH + HOOC–R’ --> R–COO-OC–R’ + H-OH
Ácido 1 + Ácido 2 --> Anhidrido de ácido + Agua
Características de los anhidridos de ácido
Los anhidridos de ácido se definen por las siguientes características:
- Son líquidos con olor irritante.
- Sus vapores son corrosivos si se respiran.
- Sus puntos de ebullición son más altos que los de los ácidos correspondientes.
- Al no haber átomos de hidrógeno o hidroxilos libres en un extremo, no pueden formar enlaces por puente de hidrógeno.
- Son solubles en casi todos los disolventes orgánicos.
- Al entrar en contacto con el agua se hidrolizan, es decir, se separan sus moléculas, creando los ácidos carboxílicos de los que proviene.
Nomenclatura de los anhidridos de ácido
De acuerdo con la Unión Internacional de Química Pura y Aplicada (IUPAC), los anhidridos de ácido se nombran según las cadenas R que están unidas.
- Se comienza con la palabra “anhidrido” y se escriben los nombres de los ácidos de que proviene.
- Si ambas R son idénticas, sólo se escribe un nombre.
- Si las R son diferentes, se escriben las dos palabras de los ácidos.
Para comprenderlo mejor, una serie de ejemplos:
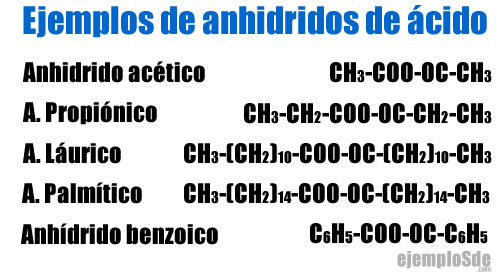
- Anhidrido acético CH3–COO–OC–CH3
- Anhidrido propiónico CH3–CH2–COO–OC–CH2–CH3
- Anhidrido butírico CH3–CH2–CH2–COO–OC–CH2–CH2–CH3
- Anhidrido láurico CH3–(CH2)10–COO–OC–(CH2)10–CH3
- Anhidrido palmítico CH3–(CH2)14–COO–OC–(CH2)14–CH3
- Anhidrido benzoico C6H5–COO–OC–C6H5
- Anhidrido acético propiónico CH3–COO–OC–CH2–CH3
- Anhidrido propiónico butírico CH3–CH2–COO–OC–CH2–CH2–CH3
- Anhidrido acético butírico CH3–COO–OC–CH2–CH2–CH3
- Anhidrido acético benzoico CH3–COO–OC–C6H5
Tipos de anhidridos de ácido
De acuerdo con las cadenas de ácido que tengan en sus extremos, los anhidridos se clasifican en dos tipos:
- Simétricos
- Mixtos
Anhidridos de ácido simétricos
Los anhidridos de ácido son simétricos si sus cadenas de radical alkilo R son iguales. Por ejemplo:
- Anhidrido acético CH3–COO–OC–CH3
- Anhidrido propiónico CH3–CH2–COO–OC–CH2–CH3
- Anhidrido butírico CH3–CH2–CH2–COO–OC–CH2–CH2–CH3
- Anhidrido láurico CH3–(CH2)10–COO–OC–(CH2)10–CH3
- Anhidrido palmítico CH3–(CH2)14–COO–OC–(CH2)14–CH3
Anhidridos de ácido mixtos
Los anhidridos de ácido son mixtos si sus cadenas de radical alkilo R son distintas. Por ejemplo:
- Anhidrido acético propiónico CH3–COO–OC–CH2–CH3
- Anhidrido propiónico butírico CH3–CH2–COO–OC–CH2–CH2–CH3
- Anhidrido acético butírico CH3–COO–OC–CH2–CH2–CH3
- Anhidrido acético láurico CH3–COO–OC–(CH2)10–CH3
- Anhidrido acético palmítico CH3–COO–OC–(CH2)14–CH3
Anhidrido acético
El anhidrido acético, cuya fórmula semidesarrollada es CH3–COO–OC–CH3, es el anhídrido de ácido más importante y tiene múltiples aplicaciones en síntesis farmacéuticas e industriales. Por ello, es importante observar sus propiedades por separado:
- Apariencia: líquido incoloro.
- Olor: a vinagre, irritante, picante.
- Fórmula condensada: (CH3CO)2
- Peso molecular: 102.09 g/mol
- Densidad: 1.083 g/mL
- Punto de ebullición: 139.60°C
- Punto de fusión: –73°C
- Reactividad: es corrosivo.
- Altamente tóxico en agua.
Usos de los anhidridos de ácido
Los anhidridos de ácido son de gran importancia en la industria farmacéutica. Por ejemplo, el anhídrido acético CH3–COO–OC–CH3 ayuda a insertar un grupo acilo en un producto. Es el caso de la aspirina, el popular medicamento utilizado como antipirético (para reducir la fiebre) y antiinflamatorio, que se fabrica colocando un grupo acetilo (CH3–CO–) al ácido salicílico, que es ácido orto-hidroxi-benzoico. El resultado es el ácido acetilsalicílico, componente activo del fármaco.
El anhídrido acético CH3–COO–OC–CH3 también participa en la síntesis del acetaminofeno. Cumple con la misma función de agregar un grupo acetilo (CH3–CO–), en este caso sobre la para-hidroxi-anilina. El acetaminofeno se toma para aliviar el dolor de leve a moderado en cabeza, muelas, espalda, garganta, musculares, periodo menstrual, además para aminorar resfriados.
Ejemplos de anhidridos de ácido
- Anhidrido acético CH3–COO–OC–CH3
- Anhidrido propiónico CH3–CH2–COO–OC–CH2–CH3
- Anhidrido butírico CH3–CH2–CH2–COO–OC–CH2–CH2–CH3
- Anhidrido valeriánico CH3–CH2–CH2–CH2–COO–OC–CH2–CH2–CH2–CH3
- Anhidrido caproico CH3–(CH2)4–COO–OC–(CH2)4–CH3
- Anhidrido enántico CH3–(CH2)5–COO–OC–(CH2)5–CH3
- Anhidrido láurico CH3–(CH2)10–COO–OC–(CH2)10–CH3
- Anhidrido palmítico CH3–(CH2)14–COO–OC–(CH2)14–CH3
- Anhidrido araquídico CH3–(CH2)18–COO–OC–(CH2)18–CH3
- Anhidrido benzoico C6H5–COO–OC–C6H5
- Anhidrido acético propiónico CH3–COO–OC–CH2–CH3
- Anhidrido propiónico butírico CH3–CH2–COO–OC–CH2–CH2–CH3
- Anhidrido acético butírico CH3–COO–OC–CH2–CH2–CH3
- Anhidrido acético láurico CH3–COO–OC–(CH2)10–CH3
- Anhidrido acético palmítico CH3–COO–OC–(CH2)14–CH3
- Anhidrido acético benzoico CH3–COO–OC–C6H5
- Anhidrido butírico caproico CH3–CH2–CH2–COO–OC–(CH2)4–CH3
- Anhidrido mirístico esteárico CH3–(CH2)12–COO–OC–(CH2)16–CH3
- Anhidrido láurico araquídico CH3–(CH2)10–COO–OC–(CH2)18–CH3
- Anhidrido enántico láurico CH3–(CH2)5–COO–OC–(CH2)10–CH3
Sigue leyendo con:
